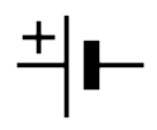ISLLg - 4TTA - E05
Les
piles, accumulateurs et panneaux photovoltaïques
Introduction
Les générateurs électriques
Les dispositifs permettant la transformation d’une énergie non
électrique en énergie électrique sont appelés des générateurs d’énergie
électrique.
En 4ème année, nous allons étudier les générateurs chimiques (piles,
accumulateurs, batteries, piles rechargeables), ainsi que les
convertisseurs photovoltaïques. En fin d'année, nous découvrirons
l'alternateur et la dynamo qui sont des générateurs du type mécanique.
Vous verrez plus en détail le fonctionnement de ces
derniers au 3° degré.
Les piles
Une pile est constituée des éléments suivants :
- un réservoir.
- un électrolyte.
- deux électrodes plongeant dans l'électrolyte.
Le réservoir
Il ne doit pas réagir chimiquement avec les autres
constituants de la pile (ex : cuve en plastique).
Mais dans certaines piles, le réservoir sert également d'électrode (ex :
cuve en zinc).
L'électrolyte
Un électrolyte est une substance conductrice, car elle contient des
ions mobiles. Il existe des électrolytes liquides et solides. Les
électrolytes liquides sont les électrolytes aqueux dans lesquels les
ions proviennent d'un sel soluble ou d'un acide, ils sont parfois
mélangés avec des produits pour former un gel afin que la pile ne
coule pas si on la renverse. Les électrolytes
solides sont des cristaux dans lesquels certains ions sont mobiles
(dans certaines piles au Lithium). Un
électrolyte est dit "fort" s'il libère beaucoup d'ions (ex : acide
sulfurique), il est dit
"faible" s'il en libère peu.
Par exemple : le sel de table (chlorure de sodium, NaCl) se
dissocie en ions, lorsque solubilisé dans l’eau. Une substance
non-électrolyte ne conduit pas le courant électrique une fois dissoute
dans l’eau. Par exemple: le sucre (comme le glucose) ne se dissocie pas
en ions une fois solubilisé dans l’eau.
Les électrolytes les plus courant sont :
- solution aqueuse de chlorure de sodium : H2O
+ NaCl <=> H2O
+ Na+(aq) +
Cl-(aq)
- solution aqueuse d'acide sulfurique (batteries au plomb) :
2 H2O
+ H2SO4
<=> H3O+(aq)
+ SO42-(aq).
- solutions de potasse K des batteries alcalines de types Ni-Cd
ou Ni-MH ;
- solutions de LiPF6 dans des mélanges de solvants organiques
de types
« carbonates » des batteries lithium-ion;
Les électrodes
Les électrodes sont des conducteurs de nature différente pour que la
pile génère une certaine tension. Ces conducteurs sont classés selon
leur potentiel d'oxydo-réduction. C'est est une grandeur empirique
exprimée en Volt et
notée ε.
| Elément | ε en Volt |
| MnO2 | 1,23 |
| Mercure | 0,854 |
| Argent | 0,799 |
| Cuivre | 0,34 |
| Carbone | 0,19 |
| Plomb | -0,13 |
| Etain | -0,136 |
| Nickel | -0,257 |
| Cadmium | -0,403 |
| Zinc | -0,76 |
| Aluminium | -1,67 |
| Lithium | -3,045 |
L'électrode la plus haut dans la liste sera la borne + de la pile.
L'électrode la plus bas dans la liste sera la borne - de la pile.
Plus l'écart entre les ε des électrodes sera grand, plus la tension aux bornes de la pile sera grande.
Exemples :
- Il n'y a pas de pile plomb(+)/étain(-), car la tension serait quasi nulle.
- Une pile cuivre(+)/zinc(-) délivre une tension plus grande qu'une plomb(+)/zinc(-).
- Le lithium sera toujours une borne - car il n'a pas d'élément inférieur dans la liste.
- Le plomb (milieu de liste) est une borne + dans la pile plomb/zinc ; ou une borne - dans la pile cuivre/plomb.
Réaction chimique
Lorsque
la borne + est reliée à la borne - via un récepteur, un courant circule
dans le circuit. Ce courant résulte d'une réaction chimique entre les
électrodes et l'électrolyte.
Exemple de la pile de Volta (Cu / H2SO4 + n H2O / Zn) :
- Au niveau de l'électrode de Zn : Zn = 2 e- + Zn2+
- Au niveau de l'électrode de Cu : 2 H2O + 2 e- = 2 HO- + H2
Pour générer deux électrons, la pile de Volta consomme un atome de Zn et deux molécules d'eau.
Lorsqu'un
élément de la réction chimique a complètement réagi (ex : électrode de
zinc complètement rongée), le courant devient nul : la pile/batterie
est "plate" ou "vide".
Si
la réaction chimique est irrévesible (ex : électrode de zinc
complètement rongée) : il s'agit d'une pile, qui ne pourra jamais
être rechargée.
Si la réaction chimique est réversible : il s'agit
d'un accumulateur (ou batterie, ou pile rechargeable) qui pourra être
rechargé en injectant un courant dans l'accumulateur pour reconstituer
les éléments chimiques de départ.
La réversibilité de la réaction chimique dépend des constituants de la pile/batterie.
ATTENTION : Certaines piles (ex : Volta) ou batterie (ex : au plomb) peuvent dégager des gaz très explosifs (H2). Il ne faut les utiliser que dans des locaux correctement ventilés et en absence de flammes ou d'étincelles !
Technologie
Il existe 4 grandes technologies de piles grand public :
- Pile alcaline 1,5 V ( ⊝ Zn / Zn(OH)2- / K+ + OH- / MnO(OH)
/ MnO2 / C ⊕ ).
- Pile saline carbone-zinc 1,5 V. Pour des appareils à
faibles besoins ( ⊝ Zn / Zn2+ / NH4+ + Cl- / MnO(OH) / MnO2 / C ⊕ ).
- Pile au lithium 1,5 V (appelée aussi L91), capable de
maintenir très longtemps la tension électrique, et de fournir un
courant élevé.
- On trouve aussi des piles à l'oxyde d'argent (certaines
piles boutons pour montres) ou des piles zinc-air (utilisées notamment
dans les prothèses auditives) (⊝ Zn / ZnO // Ag2O / Ag / C ⊕).
Il existe 4 grandes technologies de batteries grand public :
- Batterie au Plomb 2V (Pb), voiture, centrale d'alarme
- Batterie Cadmium - Nickel (Ni-Cd), interdite car trop polluante
- Batterie Nickel Metal Hydride 1,2V (NiMh), modélisme, photo, jouets
- Batterie au Lithium 3,6V (Li), GSM, photo, modélisme
Recyclage
Les piles et batteries usagées sont des déchets à traiter avec précaution. Elles
contiennent des métaux (nickel, cadmium, mercure, plomb, fer, zinc ou
lithium) dont certains sont toxiques et nocifs pour l'environnement. En
outre, les piles ne sont évidemment pas biodégradables.
Le principal danger direct pour l'homme, et de loin, est l'ingestion
par les jeunes enfants. Si les constituants de la pile sont libérés
dans le tube digestif, ils peuvent provoquer un empoisonnement. Les
soins médicaux permettent généralement d'éviter le pire, mais on
déplore malheureusement des décès chez les jeunes enfants. Il faut être
extrêmement vigilant, notamment pour les piles de petite taille.
En date de 2009, les métaux lourds ont été éliminés de la plupart des
piles vendues sur le marché. Ainsi les piles alcalines ne contiennent
plus de métaux lourds (sauf à l'état de trace), la loi l'interdisant
depuis des années. Certaines piles boutons en revanche contiennent
encore du mercure qui est un métal lourd dangereux. La fabrication et
la commercialisation des accumulateurs Ni-Cd, qui contiennent du
cadmium, a été interdite, sauf dérogation.
Les piles ne doivent pas être jetées dans une poubelle ordinaire, mais
doivent être amenées à un point de collecte (dans des magasins ou
d'autres édifices publiques, comme des collèges, ou certaines
entreprises).En effet elles contiennent des substances toxiques. En
Belgique, environ 70 % des piles étaient collectées en 2000.
Sources :
http://fr.wikipedia.org/wiki/Pile_électrique
Modélisation de la pile/batterie
La pile/batterie parfaite
La pile ou batterie est symbolisée par
La pile/batterie parfaite a toujours à ses bornes une tension E, appelée force électromotrice, exprimée en Volts.
Cette fém (force électromotrice) E ne varie pas selon le courant que débite la pile.
Cette pile/batterie parfaite génère un courant infini si on la court-circuite.
La pile/batterie réelle
Raccordons
un rhéostat variable de forte puissance sur une pile. Au
départ, le rhéostat est réglé au maximum. Diminuons sa valeur
pour faire débiter quelques ampères à la pile.

Mesurons le courant et la tension pour quelques valeurs de R.

La
tension aux bornes du générateur diminue si le courant augmente. La
caractéristique tension / courant est pratiquement une droite. Cette
variation de tension est principalement due à la résistance de
l'électrolyte de la pile. Cette résistance, s'appelle la résistance
interne de la pile.
Si on prolonge la caractéristique vers l’axe
de U, on voit que l’on trouve une valeur de tension (1.5V) pour un
courant nul. Cette tension s’appelle force électromotrice.
Si
on prolonge la caractéristique vers l’axe de I, on voit que l’on trouve
une valeur du courant (8A) pour une tension nulle. Ce courant
s’appelle courant de court-circuit.
La force électromotrice
On appelle force électromotrice (f.é.m.) E
d’un générateur, la valeur de la tension à ses bornes quand le courant
est nul. C’est la vraie cause du déplacement des électrons, donc du
courant électrique.
E se mesure simplement avec un voltmètre en parallèle sur la pile/batterie déconnectée de la charge (courant nul).
E est la valeur à vide, donc lorsque le générateur ne débite pas sur un circuit avec récepteur. Par opposition, on a U qui est la valeur de la tension en charge, lorsque le générateur débite sur un circuit avec un récepteur.
E
dépend de la nature des électrodes et de la force de l'électrolyte.
Généralement, la décharge d'une pile altère l'électrolyte, il est donc
possible d'estimer sa charge en mesurant E. Mais certaines piles ne présentent pas ce phénomène (ex : pile air-zinc des détecteurs incendies), la valeur de E reste alors constante jusqu'a leur décharge, ce qui est un atout.
La résistance interne
La
différence E – U entre la f.é.m et la tension correspondant à un
courant donné est une chute de tension (volts perdus) que l’on peut
représenter par Ug.
Cette tension Ug = r * I
où r représente la résistance interne du générateur.
On a
donc : E = U + r * I
ou U = E – r * I (loi d’ohm du générateur).
r se
calcule à partir d'une mesure de la pile chargée avec une résistance
suffisament faible que pour faire chuter la tension U de 20% à 40% (pour avoir suffisament de précision) par rapport à sa valeur à vide E : r = (E - U) / I
Cette
résistance interne dépend de la force de l'électrolyte et de la nature
des électrodes, de leur surface et de leur écartement. Les piles à
faible résistance interne capable de débiter de gros courant ont de
larges électrodes séparées par une fine couche d'électrolyte, le tout
enroulé en cylindre pour avoir un faible encombrement.
La décharge
d'une pile augmente sa résistance interne, c'est le meilleur moyen de
mesurer son usure.
Une diminution de température augmente
également la résistance interne par augmentation de la viscosité de
l'électrolyte et donc diminution de la mobilité de ses ions (ex :
voiture qui a du mal à démarrer en hiver).
Le courant de court-circuit
On appelle courant de court-circuit Icc la valeur du courant maximum pour une tension nulle. C'est une valeur théorique, IL NE FAUT JAMAIS COURT-CIRCUITER UNE PILE/BATTERIE,
cela les abime fortement, c'est dangereux (coulée d'acide, voire
explosion). Pour une pile crayon (AA / LR6) ce courant de court-circuit
peut dépasser les 10A, et pour les batteries de voitures c'est
plusieurs centaines d'Ampères !!!
Icc se calcule à partir de E et r : Icc = E / r
Modèle théorique de la pile
La pile réelle se modélise comme suit :
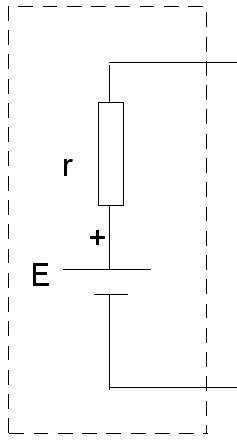
NB : les pointillés représentent le boitier de la pile : la résistance est interne à la pile.
Pile réelle = pile parfaite de fém E + résistance r en série
Pour rappel : E = U + r * I
ou U = E – r * I (loi d’ohm du générateur).
La cellule photovoltaïque
La
cellule photovoltaïque génère de l'électricité à partir de la lumière
au moyen de 2 couches de semi-conducteurs. La face exposée au
soleil est la borne - tandis que la face arrière est la borne +.
Une cellule photovoltaïque peut également se modéliser par une pile parfaite avec résistance en série.
La fém E augmente très rapidement avec la lumière pour plafonner à 0.5V
La résistance interne r
diminue plus la surface du capteur est grande et plus la lumière est
intense : pour qu'une cellule débite beaucoup de courant, il faut
qu'elle soit grande et exposée en plein soleil perpendiculairement aux
rayons du soleil (maximum 1 à 3A par dm²).
Point de fonctionnement
Pile/batterie en décharge
Équation du circuit
Un générateur (E, r) est associé à une charge purement résistive R.

La tension U = E - r*I aux bornes du générateur et la tension Ur = R * I aux bornes de la charge sont égales.
Donc E - r * I = R * I
d'où on tire
E = (R + r) * I
I = E / (R + r).
Cette formule permettant de calculer le courant dans le circuit est l'équation du circuit.
Point de fonctionnement
On
appelle point de fonctionnement F d’un générateur, associé à un
récepteur, le point d’intersection de sa caractéristique avec celle du
récepteur.
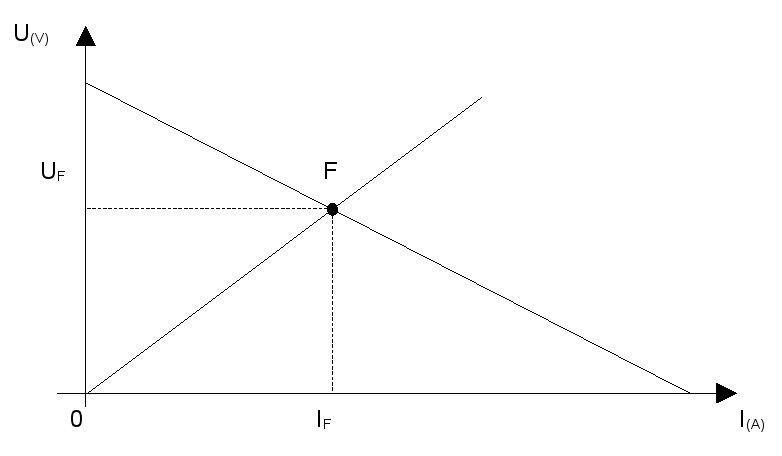
Les
coordonnées If et Uf de ce point donnent le courant fourni par le
générateur et la tension à ses bornes (ou à celles du récepteur si l'on
néglige la résistance de la ligne).
Remarquons que : Uf < E et If < Icc
Accumulateur en recharge
IL NE FAUT PAS RECHARGER LES PILES, c'est dangereux (coulée d'acide, voire explosion).
Pour
recharger un accumulateur (ou batterie, ou pile
rechargeable), il faut lui injecter un courant. Cela est généralement
réalisé en raccordant l'accumulateur à une source de tension via une
résistance série de limitation du courant.

Tension au borne de la pile : U = E + r * I
Tension au borne du générateur : Ug = U + R * I = E + r * I + R * I = E + (r + R) * I
d'où
I = (Ug - E) / (r + R)
PdansR = R * I²
Remarquons que : E < U < Ug
Caractéristiques d'une pile/batterie
Tension nominale
Donnée écrite par le fabricant sur le boîtier : E en Volts.
ex : pile de 1.5V ; batterie au plomb 2.1V ; accumulateur 1.2V ; pile Lithium 3V...
Pour les batteries, le fabricant donne parfois la plage admissible de tension de sortie :
Pb 2.1V / min 1.8V - max 2.3V
=> ne pas décharger en dessous de 1.8V
=> ne pas recharger au-dessus de 2.3V (dégagement d'hydogène à partir de 2.35V)
NiMH 1.2V / min 1V - max 1.5V
=> ne pas décharger en dessous de 1.0V
=> ne pas recharger au-dessus de 1.5V
Capacité
Donnée écrite par le fabricant sur le boîtier (pas toujours pour les piles) : Q = I * t en Ampère.heure.
Permet de calculer le temps de fonctionnement ou le temps de recharge.
À type et technologie égale, plus elle est volumineuse, plus elle a de capacité.
À capacité égale, les piles et accumulateurs au Lithium sont 2 à 4 fois plus léger que ceux au Pb ou NiMH.
Dans le cas des accumulateurs, pour ne pas les faire vieillir prématurément :
- Il ne faut pas trop les décharger, les recharger dès que E est 10% en dessous de sa valeur nominale.
- Il ne faut pas trop les charger, arrêter la recharge dès que E est 15% au dessus de sa valeur nominale.
- Le nombre de cycles charge/décharge est limité (max 1000x).
Certains
anciens accumulateurs ont un effet mémoire (Ni-Cd) : il faut complètement
les décharger avant de les recharger si on veut conserver leur capacité.
Courant maximum
Donnée parfois écrite par le fabricant sur le boîtier : Imax en Ampère.
C'est le courant maximum de charge ou de décharge.
S'il
n'est pas donné par le fabricant, considérer qu'il faut
décharger/recharger au plus vite en 1heure (exemple si Q = 2300mAh,
Imax = 2.3A). L'idéal est de décharger/recharger en minimum 10heures (exemple si Q = 40Ah,
Iidéal = 4A).
Au plus
ce courant est dépassé, au plus cela aura des conséquences graves pour
la pile/batterie : diminution de la durée de vie, échauffement
(incendie), coulée d'acide, déformation, explosion...
Auteur :
Marc PHILIPPOT - Version du 02/02/2012